Mutationskrankheiten: Kasseler und Krakauer Forschende entschlüsseln Protein-Komplex
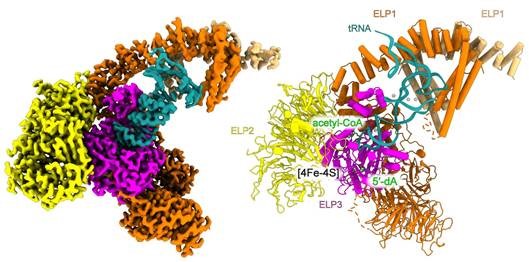 Bild: Sebastian Glatt.
Bild: Sebastian Glatt.Der menschliche Körper stellt ständig neue Proteine her, die für viele essentielle Funktionen notwendig sind. Für diesen Herstellungsprozess sind bestimmte Moleküle namens tRNAs von großer Bedeutung. Der Elongator-Komplex modifiziert Stellen auf den tRNAs, damit diese ihre Aufgabe präzise erfüllen können. Kommt es hierbei durch genetische Mutationen zu Fehlern, kann das zu schweren Krankheiten führen.
Der Elongator ist ein Protein-Komplex, der aus insgesamt sechs Untereinheiten besteht und in zwei Module aufgeteilt ist: ELP123 und ELP456. Prof. Raffael Schaffrath, Leiter des Fachgebietes Mikrobiologie erklärt: „Unser Ziel ist es, zu verstehen, wie der Proteinkomplex beim Menschen funktioniert. Die nun erstellte hochauflösende Struktur von menschlichem ELP123 ermöglicht es uns, die Positionen der Mutationen, die zu Elongator-assoziierten Erkrankungen führen, präzise und direkt zu bestimmen.“
„Wir konnten die Struktur des Elongator-Komplexes mit einer Auflösung von 2,9 Ångström (Å) darstellen – der höchsten bisher erreichten Auflösung für diesen Komplex. Die Bilder zeigen den Elongator im Komplex mit tRNA und einem Acetyl-CoA-Molekül, was wichtige Einblicke in das aktive Zentrum des Komplexes bietet. Eine überraschende Entdeckung war die Rolle eines benachbarten Uridins (eine Komponente der tRNA), das für die Aktivität des Elongators notwendig ist. Diese Erkenntnis war bisher unbekannt und erweitert das Verständnis der Funktionsweise des Komplexes erheblich“, so Prof. Sebastian Glatt, Leiter der Max Planck Forschungsgruppe an der Jagiellonian University Krakow.
Die hochauflösende Struktur ist ein wichtiger Schritt, um die Auswirkungen von Mutationen auf den Elongator-Komplex besser zu verstehen und potenzielle Behandlungsansätze gegen Krankheiten zu entwickeln, die durch von Mutationen verursachten Fehlern ausgelöst werden.
Die Studie wurde kürzlich in Nature Communications veröffentlicht: https://doi.org/10.1038/s41467-024-48251-y.
Das Forschungsprojekt wurde durch den Europäischen Forschungsrat, die Stiftung für Polnische Wissenschaft und die Deutsche Forschungsgemeinschaft unterstützt.
Kontakt:
Prof. Dr. Raffael Schaffrath
Leiter Fachgebiet Mikrobiologie
Telefon +49 561 804-4175
E-Mail: schaffrath[at]uni-kassel[dot]de